यह पेज BSEB Class 10 Chemistry के महत्वपूर्ण अध्याय ‘अम्ल, क्षारक और लवण’ पर आधारित Short Type और Long Type प्रश्न–उत्तर प्रदान करता है। यहाँ सभी प्रश्नों को सरल भाषा, स्पष्ट व्याख्या और परीक्षा-पॉइंट दृष्टिकोण से तैयार किया गया है। इसमें परिभाषाएँ, गुण, रासायनिक अभिक्रियाएँ, pH स्केल, अंतर तालिकाएँ तथा वास्तविक जीवन से जुड़े उदाहरण शामिल हैं। यह सामग्री बिहार बोर्ड परीक्षा में अच्छे अंक लाने के लिए अत्यंत उपयोगी है और छात्रों की संपूर्ण तैयारी सुनिश्चित करती है।
अम्ल भस्म और लवण | Acids, Bases and Salts - BSEB Class 10 Science
✍️ by Sibtain Sir
📚 अम्ल भस्म और लवण BSEB Class 10 Chemistry (Acids, Bases and Salts) बिहार बोर्ड कक्षा 10 विज्ञान का एक अत्यंत महत्वपूर्ण अध्याय है। इस पेज पर आपको अम्ल, क्षारक और लवण की परिभाषाएं, उनके गुण, pH स्केल, सूचक, रासायनिक अभिक्रियाएं, महत्वपूर्ण यौगिक और दैनिक जीवन में उपयोग के बारे में संपूर्ण जानकारी मिलेगी। यह सामग्री परीक्षा की दृष्टि से अत्यंत उपयोगी है। ✨

📌 मूल परिभाषाएं (Basic Definitions)
प्रश्न 1: अम्ल किसे कहते हैं?
उत्तर: वे पदार्थ जो स्वाद में खट्टे होते हैं, अम्ल कहलाते हैं।
अर्हेनियम के अनुसार: वे पदार्थ जो जल में घुलकर H⁺ (हाइड्रोजन आयन) उत्पन्न करते हैं, अम्ल (Acid) कहलाते हैं।
अर्हेनियम के अनुसार: वे पदार्थ जो जल में घुलकर H⁺ (हाइड्रोजन आयन) उत्पन्न करते हैं, अम्ल (Acid) कहलाते हैं।
🔬 उदाहरण: HCl, H₂SO₄, CH₃COOH
प्रश्न 2: क्षारक क्या है?
उत्तर: वे पदार्थ जो स्वाद में कड़वे होते हैं, क्षार कहलाते हैं।
अर्हेनियम के अनुसार: वे पदार्थ जो जल में घुलकर OH⁻ (हाइड्रॉक्सिल आयन) देते हैं, क्षारक (Base/Alkali) कहलाते हैं।
अर्हेनियम के अनुसार: वे पदार्थ जो जल में घुलकर OH⁻ (हाइड्रॉक्सिल आयन) देते हैं, क्षारक (Base/Alkali) कहलाते हैं।
🔬 उदाहरण: NaOH, KOH, Ca(OH)₂
प्रश्न 3: लवण किसे कहते हैं?
उत्तर: वे पदार्थ जो अम्ल और क्षार की अभिक्रिया से प्राप्त होते हैं, लवण कहलाते हैं। इस अभिक्रिया को उदासीनीकरण अभिक्रिया (Neutralization Reaction) कहते हैं।
🔬 उदाहरण:
HCl + NaOH → NaCl + H₂O
HCl + NaOH → NaCl + H₂O
⚗️ अम्ल के गुण और अभिक्रियाएं
प्रश्न 4: अम्ल का जलीय विलयन क्यों विद्युत का चालन करता है?
उत्तर: शुष्क अम्ल विद्युत धारा का चालन नहीं करता है क्योंकि इसमें कोई भी आयनिक पदार्थ नहीं होता। जब हम अम्ल में जल मिलाते हैं तो अम्ल जल से अभिक्रिया कर H⁺ (हाइड्रोजन का धनायन) आयन देता है, जिसके फलस्वरूप विद्युत का चालन होने लगता है।
📝 निष्कर्ष: H⁺ आयन के चलते ही अम्ल का जलीय विलयन विद्युत का चालन करता है।
प्रश्न 5: जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है?
उत्तर: जल की अनुपस्थिति में अम्ल H⁺ नहीं देता है क्योंकि हाइड्रोजन आयन देने के लिए किसी भी अम्ल को जल का होना अनिवार्य होता है। अतः जल मौजूद न हो तो अम्ल अम्लीयता प्रदर्शित नहीं करता है।
प्रश्न 6: अम्ल को तनुकृत करते समय अम्ल को जल में मिलाना चाहिए न कि जल को अम्ल में। क्यों?
उत्तर: अम्ल को तनुकृत (dilute) करते समय हमेशा अम्ल को धीरे-धीरे जल में मिलाना चाहिए, न कि जल को अम्ल में। इसका मुख्य कारण यह है कि यह प्रक्रिया अत्यधिक ऊष्माक्षेपी (highly exothermic) होती है। जब जल को सीधे सांद्र अम्ल में मिलाया जाता है तो बहुत अधिक ऊष्मा निकलती है जो विलयन को उबाल सकती है और खतरनाक हो सकती है।
प्रश्न 7: धातु को अम्ल के साथ अभिक्रिया कराने से कौन सी गैस निकलती है? एक उदाहरण दें।
उत्तर: धातु को अम्ल के साथ अभिक्रिया कराने पर हाइड्रोजन गैस (H₂) निकलती है।
🔬 उदाहरण:
Zn + 2HCl → ZnCl₂ + H₂↑
Zn + 2HCl → ZnCl₂ + H₂↑
प्रश्न 8: जब जिंक (जस्ता) धातु की तनु सल्फ्यूरिक अम्ल से अभिक्रिया कराई जाती है, तो कौन-सी गैस निकलती है? अभिक्रिया का समीकरण दें।
उत्तर: जिंक और तनु सल्फ्यूरिक अम्ल की अभिक्रिया से हाइड्रोजन गैस उत्पन्न होती है।
🔬 समीकरण:
Zn + H₂SO₄ → ZnSO₄ + H₂↑
Zn + H₂SO₄ → ZnSO₄ + H₂↑
प्रश्न 9: धातु की अभिक्रिया जल से कराने पर क्या होता है?
उत्तर: धातु की अभिक्रिया जल (Water) से कराने पर सामान्यतः धातु हाइड्रॉक्साइड बनता है और हाइड्रोजन गैस (H₂) निकलती है।
🔬 समीकरण:
2Na + 2H₂O → 2NaOH + H₂↑
2Na + 2H₂O → 2NaOH + H₂↑
प्रश्न 10: जिंक को आयरन सल्फेट के विलयन में डालने से क्या होता है? अभिक्रिया का रासायनिक समीकरण लिखें।
उत्तर: जब जिंक (Zn) को आयरन सल्फेट (FeSO₄) के विलयन में डाला जाता है, तो जिंक आयरन को विस्थापित (Displace) कर देता है। क्योंकि जिंक, आयरन से अधिक अभिक्रियाशील (reactive) धातु है।
🔬 रासायनिक समीकरण:
Zn + FeSO₄ → ZnSO₄ + Fe
Zn + FeSO₄ → ZnSO₄ + Fe
प्रश्न 11: हाइड्रोक्लोरिक अम्ल के कुछ उपयोगों को लिखिए।
उत्तर: हाइड्रोक्लोरिक अम्ल के निम्न उपयोग हैं:
- • PVC प्लास्टिक बनाने में
- • धातु की सफाई में
- • दवाई व रसायन के निर्माण में
- • अम्लीयता बढ़ाने वाले प्रयोग में
प्रश्न 12: अम्ल से होने वाली हानियों को लिखें?
उत्तर: अम्ल से होने वाली हानियां:
- • त्वचा पर जलन और छाले
- • आंखों में गंभीर क्षति
- • धातुओं का संक्षारण
- • कपड़ों को नुकसान
- • अधिक मात्रा में विषैला प्रभाव

🧪 सूचक और pH स्केल
प्रश्न 13: सूचक (Indicators) क्या है? एक सूचक का नाम बताएँ।
उत्तर: सूचक वे पदार्थ होते हैं जो किसी विलयन (Solution) के अम्लीय, क्षारीय या उदासीन होने पर अपना रंग बदल लेते हैं। यानी, इनका उपयोग यह जानने के लिए किया जाता है कि कोई पदार्थ Acid (अम्ल) है या Base (क्षार)।
सूचक के तीन प्रकार हैं:
📝 उदाहरण: लिटमस (Litmus)
सूचक के तीन प्रकार हैं:
- 1. प्राकृतिक सूचक: जो प्रकृति से प्राप्त होते हैं, जैसे लिटमस (लाइकेन से)
- 2. कृत्रिम या संश्लेषित सूचक: जो मनुष्यों द्वारा रासायनिक रूप से बनाए जाते हैं, जैसे मेथिल ऑरेंज
- 3. गंधीय सूचक: जो अम्ल या क्षार के साथ मिलाने पर अपनी गंध (smell) में परिवर्तन करते हैं, जैसे वैनिला (Vanilla) और प्याज (Onion)
प्रश्न 14: शुष्क HCl गैस शुष्क लिटमस पत्र का रंग क्यों नहीं बदलती है?
उत्तर: शुष्क (Dry) HCl गैस शुष्क लिटमस पत्र का रंग इसलिए नहीं बदलती, क्योंकि उसमें नमी (Water) नहीं होती। लिटमस का रंग बदलने के लिए HCl को H⁺ आयन बनाने पड़ते हैं, और HCl केवल पानी की उपस्थिति में ही H⁺ आयन बनाता है।
प्रश्न 15: गैस से भरे एक पात्र में लिटमस पत्र का रंग क्यों नहीं बदलता है?
उत्तर: लिटमस का रंग तभी बदलता है जब अम्ल या क्षार पानी में घुलकर आयन (H⁺ या OH⁻) बनाते हैं। गैस अवस्था में यह आयन नहीं बनते, इसलिए गैस से भरे पात्र में लिटमस का रंग अपरिवर्तित रहता है।
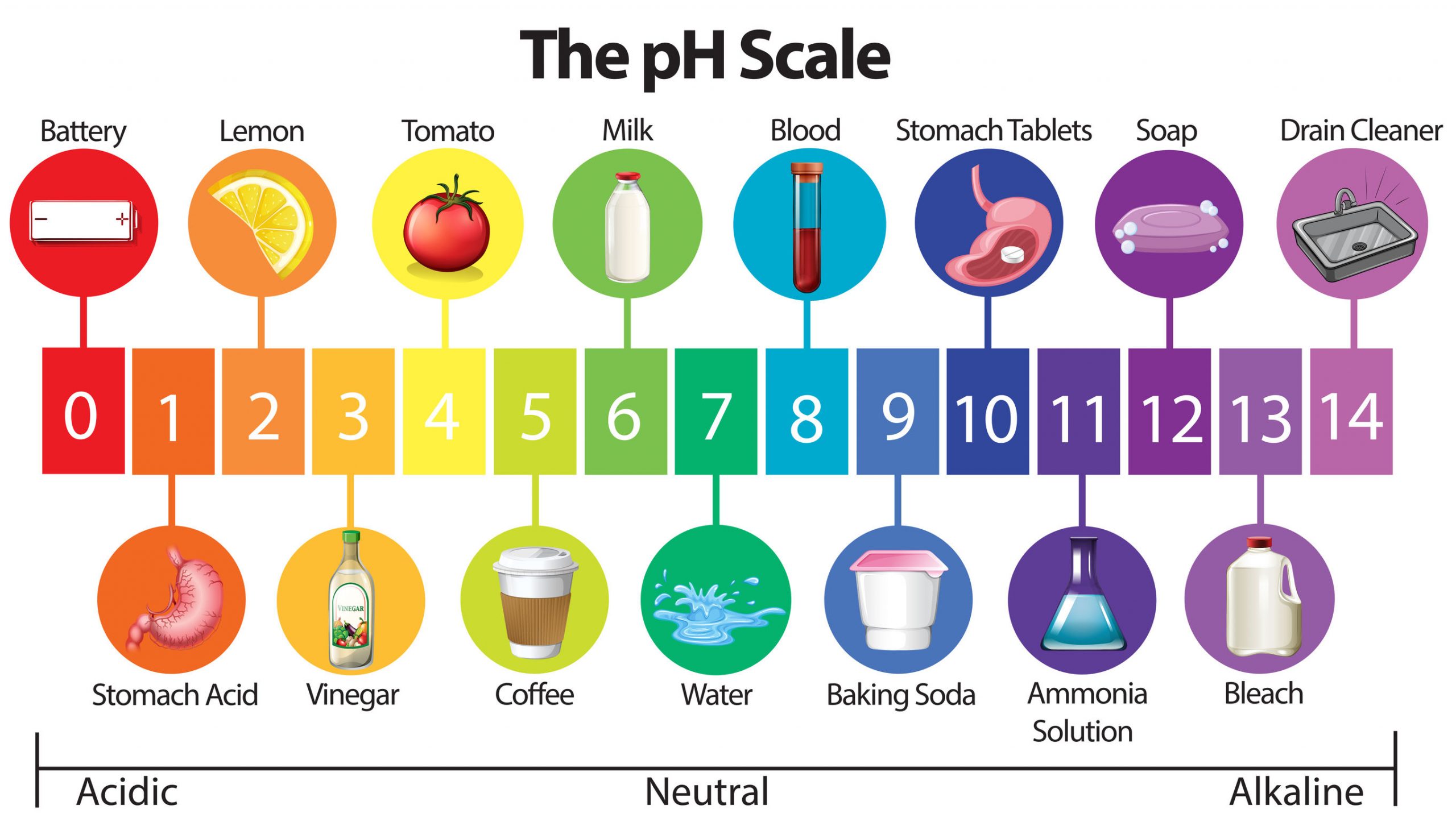
प्रश्न 16: pH मान क्या है? उदासीन विलयन का pH मान क्या है?
उत्तर: pH मान किसी विलयन की अम्लीयता या क्षारीयता को दर्शाने वाला पैमाना है। यह बताता है कि विलयन में H⁺ आयनों की मात्रा कितनी है।
उदासीन विलयन का pH मान = 7
📊 pH स्केल:
• pH < 7 → अम्लीय विलयन
• pH = 7 → उदासीन विलयन
• pH > 7 → क्षारीय विलयन
• pH < 7 → अम्लीय विलयन
• pH = 7 → उदासीन विलयन
• pH > 7 → क्षारीय विलयन
उदासीन विलयन का pH मान = 7
प्रश्न 17: किसी विलयन में हाइड्रोजन आयन की सांद्रता को मापने के लिए किस स्केल का उपयोग किया जाता है? इसका क्या महत्व है?
उत्तर: हाइड्रोजन आयन की सांद्रता मापने हेतु pH स्केल प्रयोग किया जाता है।
महत्व: pH स्केल से यह पता चलता है कि कोई विलयन अम्लीय, क्षारीय या उदासीन है। यह स्केल हमें किसी पदार्थ की अम्लीयता, क्षारीयता, तथा उसके प्रभाव (जैसे संक्षारण, उपयोग, सुरक्षा) को समझने में मदद करता है।
महत्व: pH स्केल से यह पता चलता है कि कोई विलयन अम्लीय, क्षारीय या उदासीन है। यह स्केल हमें किसी पदार्थ की अम्लीयता, क्षारीयता, तथा उसके प्रभाव (जैसे संक्षारण, उपयोग, सुरक्षा) को समझने में मदद करता है।
प्रश्न 18: हाइड्रोजन आयन (H⁺) जल में किस रूप में विद्यमान रहते हैं?
उत्तर: हाइड्रोजन आयन जल में हाइड्रोनियम आयन (H₃O⁺) के रूप में विद्यमान रहते हैं।
H⁺ + H₂O → H₃O⁺
🧂 महत्वपूर्ण लवण और यौगिक
प्रश्न 19: अम्लीय और भस्मीय मूलक क्या है? उदाहरण के साथ समझाएं।
उत्तर:
(क) अम्लीय मूलक (Acidic Radical): अम्ल के ऋणायन को अम्लीय मूलक कहते हैं। अर्थात अम्ल से प्राप्त मूलक (ऋणआयन) अम्लीय मूलक कहे जाते हैं।
(ख) भस्मीय मूलक (Basic Radical): क्षारक के धनायन को भस्मीय मूलक कहते हैं। अर्थात भस्म से प्राप्त मूलक (धनआयन) भस्मीय मूलक कहलाते हैं।
(क) अम्लीय मूलक (Acidic Radical): अम्ल के ऋणायन को अम्लीय मूलक कहते हैं। अर्थात अम्ल से प्राप्त मूलक (ऋणआयन) अम्लीय मूलक कहे जाते हैं।
उदाहरण: Cl⁻, SO₄²⁻
(ख) भस्मीय मूलक (Basic Radical): क्षारक के धनायन को भस्मीय मूलक कहते हैं। अर्थात भस्म से प्राप्त मूलक (धनआयन) भस्मीय मूलक कहलाते हैं।
उदाहरण: Na⁺, Ca²⁺
प्रश्न 20: उदासीनीकरण अभिक्रिया क्या है? उदाहरण दें।
उत्तर: उदासीनीकरण अभिक्रिया वह रासायनिक अभिक्रिया है जिसमें कोई अम्ल (Acid) और भस्म या क्षार (Base/Alkali) आपस में अभिक्रिया करके लवण (Salt) और जल (Water) का निर्माण करते हैं।
🔬 उदाहरण:
HCl + NaOH → NaCl + H₂O
HCl + NaOH → NaCl + H₂O
प्रश्न 21: उत्फुलन से क्या समझते हैं? उत्फुलन का प्रदर्शन करने वाले एक यौगिक का नाम बताएँ।
उत्तर: उत्फुलन वह प्रक्रिया है जिसमें कुछ क्रिस्टलीय लवण हवा के संपर्क में आने पर अपने क्रिस्टलीकरण जल (Water of Crystallization) का कुछ भाग खो देते हैं और उनकी सतह पर सफेद पाउडर की परत दिखाई देने लगती है।
📝 उदाहरण: सोडियम सल्फेट डिकाहाइड्रेट (Na₂SO₄·10H₂O) - ग्लॉबर लवण (Glauber's salt)
प्रश्न 22: प्रस्वेदी लवण क्या है? उदाहरण दें।
उत्तर: जो लवण हवा की नमी को अवशोषित कर स्वयं घुलकर तरल बन जाएं, उसे प्रस्वेदी लवण कहते हैं।
📝 उदाहरण: कैल्शियम क्लोराइड (CaCl₂), पोटैशियम हाइड्रॉक्साइड (KOH)
प्रश्न 23: क्रिस्टलन जल (Water of Crystallisation) क्या है? उदाहरण दें।
उत्तर: क्रिस्टलन जल (Water of Crystallisation) किसी लवण (salt) के एक सूत्र इकाई (one formula unit) में उपस्थित जल के अणुओं की निश्चित संख्या को कहते हैं।
📝 उदाहरण: CuSO₄·5H₂O (ब्लू विट्रिऑल), CaSO₄·2H₂O (जिप्सम)
प्रश्न 24: उत्फुलनशील, प्रस्वेदी और द्रव्याग्राही लवण से क्या समझते हैं? समझाकर लिखें।
उत्तर:
1. उत्फुलनशील लवण (Efflorescent Salts):
वे लवण जो वायुमंडल की शुष्क हवा में अपना जल-योजन खो देते हैं और सूखकर पाउडर बन जाते हैं।
2. प्रस्वेदी लवण (Deliquescent Salts):
वे लवण जो हवा से नमी को अत्यधिक सोख लेते हैं और घुलकर तरल रूप ले लेते हैं।
3. द्रव्याग्राही लवण (Hygroscopic Salts):
वे पदार्थ जो वायुमंडल की नमी को केवल अवशोषित करते हैं, लेकिन द्रव रूप में नहीं बदलते।
1. उत्फुलनशील लवण (Efflorescent Salts):
वे लवण जो वायुमंडल की शुष्क हवा में अपना जल-योजन खो देते हैं और सूखकर पाउडर बन जाते हैं।
उदाहरण: Na₂SO₄·10H₂O, जिप्सम
2. प्रस्वेदी लवण (Deliquescent Salts):
वे लवण जो हवा से नमी को अत्यधिक सोख लेते हैं और घुलकर तरल रूप ले लेते हैं।
उदाहरण: CaCl₂, MgCl₂, NaOH, KOH
3. द्रव्याग्राही लवण (Hygroscopic Salts):
वे पदार्थ जो वायुमंडल की नमी को केवल अवशोषित करते हैं, लेकिन द्रव रूप में नहीं बदलते।
उदाहरण: H₂SO₄, P₂O₅, सिलिका जैल
🧴 बेकिंग सोडा और संबंधित यौगिक
प्रश्न 25: सोडियम हाइड्रोजन कार्बोनेट (NaHCO₃) के तीन उपयोग लिखें।
उत्तर:
- (i) बेकिंग सोडा के रूप में केक-ब्रेड को फूलाने में
- (ii) पेट की अम्लीयता कम करने में (एंटासिड)
- (iii) अग्निशामक (Fire extinguisher) में उपयोग
प्रश्न 26: केक या पावरोटी बनाने में बेकिंग पाउडर का उपयोग क्यों किया जाता है?
उत्तर: बेकिंग पाउडर गरम होने पर CO₂ गैस छोड़ता है। यह गैस केक/ब्रेड को फूलाती है, जिससे वे नरम और फूले हुए बनते हैं।
प्रश्न 27: बेकिंग सोडा (Baking Soda) का रासायनिक नाम और सूत्र लिखें तथा इसे गर्म करने पर होने वाली अभिक्रिया का समीकरण लिखें।
उत्तर:
रासायनिक नाम: सोडियम हाइड्रोजन कार्बोनेट
सूत्र: NaHCO₃
रासायनिक नाम: सोडियम हाइड्रोजन कार्बोनेट
सूत्र: NaHCO₃
🔬 गर्म करने पर अभिक्रिया:
2NaHCO₃ → Na₂CO₃ + CO₂ + H₂O
2NaHCO₃ → Na₂CO₃ + CO₂ + H₂O
प्रश्न 28: धोबिया सोडा एवं बेकिंग सोडा में अंतर स्पष्ट करें।
उत्तर:
| धोबिया सोडा | बेकिंग सोडा |
|---|---|
| रासायनिक नाम: Na₂CO₃·10H₂O | रासायनिक नाम: NaHCO₃ |
| इसे धुलाई सोडा कहा जाता है | इसे बेकिंग सोडा कहते हैं |
| कपड़े धोने में उपयोग | केक-ब्रेड बनाने, एंटासिड में उपयोग |
🏭 अन्य महत्वपूर्ण यौगिक
प्रश्न 29: ब्लीचिंग पाउडर बनाने की विधि एवं उपयोगिता लिखें।
उत्तर:
विधि: क्लोरीन गैस को बुझा हुए चूने Ca(OH)₂ पर प्रवाहित करने से ब्लीचिंग पाउडर बनता है।
उपयोग:
विधि: क्लोरीन गैस को बुझा हुए चूने Ca(OH)₂ पर प्रवाहित करने से ब्लीचिंग पाउडर बनता है।
Ca(OH)₂ + Cl₂ → CaOCl₂ + H₂O
उपयोग:
- • कपड़े व पेपर को सफेद करने में
- • जल शुद्धिकरण में
- • कीटाणुनाशक के रूप में
प्रश्न 30: विरंजक चूर्ण (Bleaching Powder) का रासायनिक नाम और सूत्र लिखें तथा इसके दो उपयोग बताएं।
उत्तर:
रासायनिक नाम: कैल्शियम ऑक्सीक्लोराइड
सूत्र: CaOCl₂
उपयोग:
रासायनिक नाम: कैल्शियम ऑक्सीक्लोराइड
सूत्र: CaOCl₂
उपयोग:
- (i) कपड़ों को सफेद करने में
- (ii) पानी के कीटाणुनाशन में
प्रश्न 31: विरंजक चूर्ण का इस्तेमाल बताएँ?
उत्तर: विरंजक चूर्ण के उपयोग:
- • जल शुद्धिकरण और कीटाणुनाशन
- • कपड़ों और कागज को सफेद करना
- • औद्योगिक प्रक्रियाओं में ब्लीचिंग एजेंट
- • तैराकी पूल का रखरखाव
प्रश्न 32: प्लास्टर ऑफ पेरिस की जल के साथ अभिक्रिया के लिए समीकरण लिखिए तथा उपयोग बताएँ।
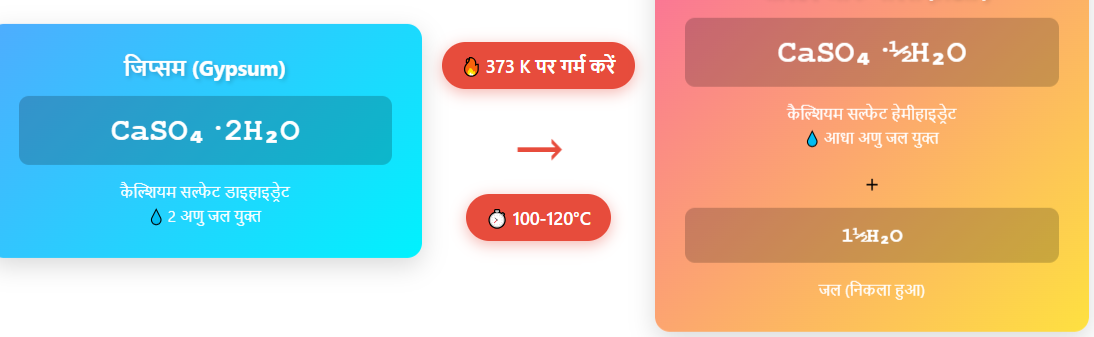
उत्तर: जब प्लास्टर ऑफ पेरिस को जल के साथ मिलाया जाता है तो यह जिप्सम (Gypsum) में बदल जाता है।
उपयोग:
🔬 रासायनिक समीकरण:
CaSO₄·½H₂O + 1½H₂O → CaSO₄·2H₂O
CaSO₄·½H₂O + 1½H₂O → CaSO₄·2H₂O
उपयोग:
- • मूर्ति बनाने में
- • टूटी हड्डियों को जोड़ने में
प्रश्न 33: कठोर जल को मृदु करने के लिए सोडियम यौगिक का उपयोग क्यों किया जाता है? उसका नाम लिखें।
उत्तर: कठोर जल (Hard Water) को मृदु (Soft) बनाने के लिए सोडियम कार्बोनेट (Na₂CO₃) नामक सोडियम यौगिक का उपयोग किया जाता है। यह कठोर जल में उपस्थित Ca²⁺ और Mg²⁺ आयनों को अवक्षेपित कर देता है।
प्रश्न 34: सोडियम कार्बोनेट का जलीय विलयन क्षारीय होता है, क्यों?
उत्तर: सोडियम कार्बोनेट (Na₂CO₃) का जलीय विलयन क्षारीय (Basic) होता है क्योंकि इसमें मौजूद कार्बोनेट आयन (CO₃²⁻) पानी के साथ अभिक्रिया करके हाइड्रॉक्साइड आयन (OH⁻) उत्पन्न करता है। OH⁻ आयन किसी भी विलयन को क्षारीय बना देते हैं।

🧼 साबुन और अपमार्जक
प्रश्न 35: अपमार्जक क्या है? उदाहरण दें।
उत्तर: अपमार्जक का शाब्दिक अर्थ साफ करने वाला है। अपमार्जक एक लंबी श्रृंखला वाला कार्बोक्सिल अम्ल के अमोनियम एवं सल्फेट लवण को अपमार्जक कहा जाता है।
📝 उदाहरण: सोडियम लॉरिल सल्फेट
प्रश्न 36: साबुन और अपमार्जक में अंतर लिखें।
उत्तर:
| क्रम | साबुन (Soap) | अपमार्जक (Detergent) |
|---|---|---|
| 1. | साबुन वसीय अम्लों के सोडियम या पोटैशियम लवण होते हैं | डिटर्जेंट सल्फेट, सल्फोनेट या बेंजीन सल्फोनेट के लवण होते हैं |
| 2. | साबुन कठोर जल में अच्छी झाग नहीं बनाते | डिटर्जेंट कठोर जल में भी आसानी से झाग बनाते हैं |
| 3. | साबुन जैव-अवक्रमणीय होते हैं | कई डिटर्जेंट जैव-अवक्रमणीय नहीं होते |
| 4. | साबुन का उपयोग मुख्यतः स्नान और कपड़े धोने में | डिटर्जेंट कठोर जल में अधिक प्रभावी |
| 5. | साबुन से अवशेष रह सकते हैं | डिटर्जेंट कोई अवशेष नहीं छोड़ते |
🏠 दैनिक जीवन में अनुप्रयोग
प्रश्न 37: पीतल एवं ताँबे के बर्तन में दही एवं खट्टे पदार्थ नहीं रखने चाहिए, क्यों?
उत्तर: पीतल (जो तांबा और जस्ता का मिश्रण है) और तांबे के बर्तन में दही और अन्य खट्टे पदार्थ नहीं रखने चाहिए। क्योंकि दही और खट्टे पदार्थों की प्रकृति अम्लीय होती है, और ये अम्ल धातुओं (तांबा/कॉपर, जस्ता/जिंक) के साथ अभिक्रिया करके विषैले (हानिकारक) धातु लवण बनाते हैं।
प्रश्न 38: अमाशय में अम्ल की भूमिका क्या है? समझाएँ।
उत्तर: अमाशय (पेट) में हाइड्रोक्लोरिक अम्ल (HCl) पाया जाता है। इसकी भूमिकाएँ:
- • भोजन को पचाने में सहायता
- • पेप्सिन एंजाइम को सक्रिय करना
- • भोजन में मौजूद जीवाणुओं का नाश करना
- • पेट का pH लगभग 2 बनाए रखना
प्रश्न 39: दंत क्षय (Tooth Decay) से आप क्या समझते हैं? इसे रोकने के लिए क्या उपाय किए जाने चाहिए?
उत्तर: दंत क्षय वह अवस्था है जिसमें बैक्टीरिया द्वारा निर्मित अम्ल दाँतों की एनामेल को नष्ट कर देता है।
इसे रोकने के उपाय:
इसे रोकने के उपाय:
- • दाँतों की सफाई करना
- • मीठे पदार्थ कम लेना
- • फ्लोराइड टूथपेस्ट का प्रयोग करना
- • नियमित दंत-जांच कराना
प्रश्न 40: आयोडिनयुक्त नमक के सेवन (खाने) की क्यों सलाह दी जाती है?
उत्तर: आयोडीन की कमी के कारण घेंघा नामक रोग हो जाता है और आयोडीन थाईराइड ग्रंथि से निकलने वाले हार्मोन जैसे थाईरोक्सिन का संश्लेषण करता है जो घेंघा से बचाता है। यही कारण है कि आयोडीन युक्त नमक खाने की सलाह दी जाती है।
📊 तुलनात्मक प्रश्न (Comparison Questions)
प्रश्न 41: अम्ल तथा भस्म (क्षारक) में अंतर स्पष्ट करें।
उत्तर:
| क्रम | अम्ल (Acid) | क्षारक (Base) |
|---|---|---|
| 1. | अम्ल वे पदार्थ हैं जो जल में घुलने पर H⁺ आयन देते हैं | क्षारक वे पदार्थ हैं जो जल में घुलने पर OH⁻ आयन देते हैं |
| 2. | अम्ल का स्वाद खट्टा होता है | क्षारक का स्वाद कड़वा और स्पर्श में फिसलनयुक्त होता है |
| 3. | अम्ल नीले लिटमस को लाल कर देते हैं | क्षारक लाल लिटमस को नीला कर देते हैं |
| 4. | अम्ल का pH मान 7 से कम होता है | क्षारक का pH मान 7 से अधिक होता है |
| 5. | अम्ल धातुओं से अभिक्रिया करके हाइड्रोजन गैस उत्पन्न करते हैं | क्षारक धातुओं से अभिक्रिया नहीं करते (कुछ अपवाद हैं) |
| 6. | उदाहरण: HCl, H₂SO₄, CH₃COOH | उदाहरण: NaOH, KOH, Ca(OH)₂ |
📚 दीर्घ उत्तरीय प्रश्न (Long Answer Questions)
प्रश्न 42: अपने दैनिक जीवन में pH के किन्हीं पांच महत्व का उल्लेख करें।
उत्तर: pH हमारे दैनिक जीवन में अत्यंत महत्वपूर्ण भूमिका निभाता है। यह किसी पदार्थ की अम्लीयता या क्षारीयता को दर्शाता है और कई जैविक, घरेलू तथा औद्योगिक कार्यों को प्रभावित करता है।
(1) हमारे पाचन तंत्र में pH का महत्व:
मनुष्य के पेट में हाइड्रोक्लोरिक अम्ल (HCl) पाया जाता है जिसका pH लगभग 1.5 से 3.5 होता है। यह अम्ल भोजन के पाचन में सहायता करता है। जब पेट का pH असंतुलित हो जाता है, तब गैस्ट्रिक समस्या या अल्सर हो सकता है। इसे संतुलित करने के लिए एंटासिड दी जाती है।
(2) दाँतों की सुरक्षा में pH का महत्व:
मुँह में pH 5.5 से नीचे जाने पर दाँतों की एनामेल घुलने लगती है जिससे दंत क्षय होता है। फ्लोराइड युक्त टूथपेस्ट मुँह का pH संतुलित रखकर दाँतों को सुरक्षित करता है।
(3) मिट्टी की उर्वरता (Soil Fertility):
मिट्टी का pH यह तय करता है कि पौधों को पोषक तत्व कितनी मात्रा में प्राप्त होंगे। बहुत अम्लीय मिट्टी फसलों के लिए हानिकारक होती है। इसे सुधारने के लिए चूना (CaO या CaCO₃) डाला जाता है।
(4) जल की गुणवत्ता (Water Quality):
पीने के पानी का pH लगभग 6.5 से 8.5 होना चाहिए। बहुत कम pH वाला पानी जीवाणु बढ़ाता है और पाइप को नुकसान पहुंचा सकता है। बहुत अधिक pH वाला पानी कड़वा होता है और त्वचा तथा बालों को हानि पहुंचाता है।
(5) रासायनिक उद्योगों और दैनिक उत्पादों में pH का उपयोग:
pH का उपयोग साबुन, शैम्पू, सौंदर्य प्रसाधन, खाद्य पदार्थ और दवाइयाँ बनाने में किया जाता है। उदाहरण: शैम्पू का pH त्वचा और बालों के लिए उपयुक्त रखा जाता है। बेकिंग के समय बेकिंग सोडा और बेकिंग पाउडर की क्रिया pH पर निर्भर करती है।
(1) हमारे पाचन तंत्र में pH का महत्व:
मनुष्य के पेट में हाइड्रोक्लोरिक अम्ल (HCl) पाया जाता है जिसका pH लगभग 1.5 से 3.5 होता है। यह अम्ल भोजन के पाचन में सहायता करता है। जब पेट का pH असंतुलित हो जाता है, तब गैस्ट्रिक समस्या या अल्सर हो सकता है। इसे संतुलित करने के लिए एंटासिड दी जाती है।
(2) दाँतों की सुरक्षा में pH का महत्व:
मुँह में pH 5.5 से नीचे जाने पर दाँतों की एनामेल घुलने लगती है जिससे दंत क्षय होता है। फ्लोराइड युक्त टूथपेस्ट मुँह का pH संतुलित रखकर दाँतों को सुरक्षित करता है।
(3) मिट्टी की उर्वरता (Soil Fertility):
मिट्टी का pH यह तय करता है कि पौधों को पोषक तत्व कितनी मात्रा में प्राप्त होंगे। बहुत अम्लीय मिट्टी फसलों के लिए हानिकारक होती है। इसे सुधारने के लिए चूना (CaO या CaCO₃) डाला जाता है।
(4) जल की गुणवत्ता (Water Quality):
पीने के पानी का pH लगभग 6.5 से 8.5 होना चाहिए। बहुत कम pH वाला पानी जीवाणु बढ़ाता है और पाइप को नुकसान पहुंचा सकता है। बहुत अधिक pH वाला पानी कड़वा होता है और त्वचा तथा बालों को हानि पहुंचाता है।
(5) रासायनिक उद्योगों और दैनिक उत्पादों में pH का उपयोग:
pH का उपयोग साबुन, शैम्पू, सौंदर्य प्रसाधन, खाद्य पदार्थ और दवाइयाँ बनाने में किया जाता है। उदाहरण: शैम्पू का pH त्वचा और बालों के लिए उपयुक्त रखा जाता है। बेकिंग के समय बेकिंग सोडा और बेकिंग पाउडर की क्रिया pH पर निर्भर करती है।
प्रश्न 43: बेकिंग सोडा का रासायनिक नाम क्या है? इसे बनाने की विधि, गुण, एवं उपयोग का वर्णन करें।
उत्तर: बेकिंग सोडा का रासायनिक नाम सोडियम हाइड्रोजन कार्बोनेट है।
रासायनिक सूत्र: NaHCO₃
निर्माण (तैयारी की विधि):
बेकिंग सोडा का निर्माण मुख्यतः सॉल्वे प्रक्रिया (Solvay Process) द्वारा किया जाता है। इस प्रक्रिया में अमोनिया (NH₃), कार्बन डाइऑक्साइड (CO₂) तथा सोडियम क्लोराइड (NaCl) को पानी में मिलाया जाता है, तो सोडियम हाइड्रोजन कार्बोनेट (NaHCO₃) का निर्माण होता है। उत्पन्न NaHCO₃ तलछट के रूप में मिल जाता है जिसे छानकर सुखाया जाता है।
गुण (Properties):
उपयोग (Uses):
रासायनिक सूत्र: NaHCO₃
निर्माण (तैयारी की विधि):
बेकिंग सोडा का निर्माण मुख्यतः सॉल्वे प्रक्रिया (Solvay Process) द्वारा किया जाता है। इस प्रक्रिया में अमोनिया (NH₃), कार्बन डाइऑक्साइड (CO₂) तथा सोडियम क्लोराइड (NaCl) को पानी में मिलाया जाता है, तो सोडियम हाइड्रोजन कार्बोनेट (NaHCO₃) का निर्माण होता है। उत्पन्न NaHCO₃ तलछट के रूप में मिल जाता है जिसे छानकर सुखाया जाता है।
गुण (Properties):
- • यह सफेद, ठोस पाउडर होता है
- • इसका स्वाद हल्का खारा होता है
- • यह गर्म करने पर सोडियम कार्बोनेट, कार्बन डाइऑक्साइड और जल बनाता है
- • यह एक सौम्य क्षार (Mild Base) है
- • अम्ल के साथ अभिक्रिया करके CO₂ गैस उत्पन्न करता है
उपयोग (Uses):
- 1. बेकिंग/खाना पकाने में: बेकिंग सोडा को केक, बिस्किट और पकवानों में उपयोग किया जाता है। यह CO₂ गैस उत्पन्न करके मिश्रण को फूला और नरम बनाता है
- 2. अग्निशामक यंत्र में: यह जलने पर CO₂ गैस बनाता है, जो आग को फैलने नहीं देती
- 3. एंटासिड: बेकिंग सोडा पेट में अधिक अम्लता को कम करने के लिए उपयोग किया जाता है
- 4. कपड़े एवं घर की सफाई में: यह एक अच्छा सफाई एजेंट है, बदबू दूर करता है और दाग साफ करने में मदद करता है
- 5. दाँतों की सफाई में: कई टूथपेस्ट में बेकिंग सोडा मिलाया जाता है क्योंकि यह दाँतों की मैल हटाता है और pH संतुलित रखता है
प्रश्न 44: साधारण नमक का उत्पादन कैसे होता है? इसे रासायनिक उद्योग का कच्चा माल क्यों कहते हैं?
उत्तर: साधारण नमक (NaCl) का उत्पादन मुख्यतः समुद्री जल के वाष्पीकरण की प्रक्रिया द्वारा किया जाता है। समुद्र के पानी को विशेष रूप से निर्मित उथली क्यारियों (evaporation pans) में एकत्रित किया जाता है, जहाँ सूर्य के ताप और वायु की सहायता से जल का क्रमिक वाष्पीकरण होता है। जल के वाष्पित हो जाने के पश्चात क्यारियों के तल में नमक के क्रिस्टल अवशेष रूप में बच जाते हैं। इसके अतिरिक्त, भू-गर्भीय नमक-खानों से भी खनन तकनीकों के माध्यम से उच्च गुणवत्ता का नमक प्राप्त किया जाता है।
रासायनिक उद्योग का कच्चा माल क्यों:
साधारण नमक को रासायनिक उद्योग का आधारभूत कच्चा माल इसलिए माना जाता है क्योंकि यह अनेक महत्वपूर्ण रासायनिक यौगिकों के निर्माण में प्राथमिक स्रोत के रूप में उपयोग किया जाता है। इसके विद्युत अपघटन से सोडियम हाइड्रॉक्साइड (NaOH), क्लोरीन (Cl₂) तथा हाइड्रोजन (H₂) जैसी आवश्यक औद्योगिक गैसें प्राप्त होती हैं, जिनका उपयोग PVC, ब्लीचिंग पाउडर, कीटाणुनाशक, साबुन, डिटर्जेंट तथा उर्वरक उद्योगों में किया जाता है। इस प्रकार बहुविध औद्योगिक उत्पादों के निर्माण में इसकी अनिवार्य भूमिका के कारण साधारण नमक को रासायनिक उद्योग का महत्वपूर्ण कच्चा माल कहा जाता है।
रासायनिक उद्योग का कच्चा माल क्यों:
साधारण नमक को रासायनिक उद्योग का आधारभूत कच्चा माल इसलिए माना जाता है क्योंकि यह अनेक महत्वपूर्ण रासायनिक यौगिकों के निर्माण में प्राथमिक स्रोत के रूप में उपयोग किया जाता है। इसके विद्युत अपघटन से सोडियम हाइड्रॉक्साइड (NaOH), क्लोरीन (Cl₂) तथा हाइड्रोजन (H₂) जैसी आवश्यक औद्योगिक गैसें प्राप्त होती हैं, जिनका उपयोग PVC, ब्लीचिंग पाउडर, कीटाणुनाशक, साबुन, डिटर्जेंट तथा उर्वरक उद्योगों में किया जाता है। इस प्रकार बहुविध औद्योगिक उत्पादों के निर्माण में इसकी अनिवार्य भूमिका के कारण साधारण नमक को रासायनिक उद्योग का महत्वपूर्ण कच्चा माल कहा जाता है।
प्रश्न 45: धोनेवाले सोडा का निर्माण कैसे किया जाता है? इसके तीन उपयोगों को लिखें।
उत्तर:
धोनेवाले सोडा (Sodium Carbonate, Na₂CO₃·10H₂O) का निर्माण:
धोनेवाले सोडा का निर्माण सॉल्वे प्रक्रिया (Solvay Process) द्वारा किया जाता है। इस विधि में सबसे पहले अमोनिया को संतृप्त सोडियम क्लोराइड में प्रवाहित किया जाता है। इसके बाद इस विलयन में कार्बन डाइऑक्साइड गैस प्रवाहित की जाती है, जिससे सोडियम बाइकार्बोनेट (NaHCO₃) का अवक्षेप बनता है। प्राप्त अवक्षेप को छनकर गर्म करने पर यह विघटित होकर सोडियम कार्बोनेट (Na₂CO₃) में बदल जाता है। अंत में इसे जल के साथ क्रिस्टलीकृत करने पर धोनेवाला सोडा प्राप्त होता है।
धोनेवाले सोडा के तीन उपयोग:
धोनेवाले सोडा (Sodium Carbonate, Na₂CO₃·10H₂O) का निर्माण:
धोनेवाले सोडा का निर्माण सॉल्वे प्रक्रिया (Solvay Process) द्वारा किया जाता है। इस विधि में सबसे पहले अमोनिया को संतृप्त सोडियम क्लोराइड में प्रवाहित किया जाता है। इसके बाद इस विलयन में कार्बन डाइऑक्साइड गैस प्रवाहित की जाती है, जिससे सोडियम बाइकार्बोनेट (NaHCO₃) का अवक्षेप बनता है। प्राप्त अवक्षेप को छनकर गर्म करने पर यह विघटित होकर सोडियम कार्बोनेट (Na₂CO₃) में बदल जाता है। अंत में इसे जल के साथ क्रिस्टलीकृत करने पर धोनेवाला सोडा प्राप्त होता है।
धोनेवाले सोडा के तीन उपयोग:
- 1. काँच निर्माण में: सोडा-चूना काँच बनाने में यह प्रमुख कच्चा माल है
- 2. कपड़े धोने और सफाई कार्य में: यह जल की कठोरता को कम करता है तथा डिटर्जेंट की प्रभावशीलता बढ़ाता है
- 3. रसायन उद्योग में: सोडियम यौगिकों (जैसे बोरैक्स, कास्टिक सोडा) के निर्माण में इसका उपयोग होता है
प्रश्न 46: वाशिंग सोडा अथवा सोडियम कार्बोनेट का उत्पादन कैसे किया जाता है? संक्षेप में अभिक्रिया समेत लिखें। इसके उपयोग भी लिखें।
उत्तर:
वाशिंग सोडा / सोडियम कार्बोनेट (Na₂CO₃·10H₂O) का उत्पादन:
वाशिंग सोडा का निर्माण सॉल्वे प्रक्रिया (Solvay Process) से किया जाता है। इस प्रक्रिया के मुख्य चरण इस प्रकार हैं:
1. सोडियम बाइकार्बोनेट का निर्माण:
संतृप्त नमक के विलयन में अमोनिया और कार्बन डाइऑक्साइड प्रवाहित की जाती है, जिससे सोडियम बाइकार्बोनेट का अवक्षेप बनता है:
2. सोडियम बाइकार्बोनेट का तापीय अपघटन:
प्राप्त NaHCO₃ को गर्म करने पर यह विघटित होकर सोडियम कार्बोनेट बनाता है:
3. वाशिंग सोडा का निर्माण:
सोडियम कार्बोनेट को जल के साथ क्रिस्टलीकृत करने पर वाशिंग सोडा प्राप्त होता है:
वाशिंग सोडा के उपयोग:
वाशिंग सोडा / सोडियम कार्बोनेट (Na₂CO₃·10H₂O) का उत्पादन:
वाशिंग सोडा का निर्माण सॉल्वे प्रक्रिया (Solvay Process) से किया जाता है। इस प्रक्रिया के मुख्य चरण इस प्रकार हैं:
1. सोडियम बाइकार्बोनेट का निर्माण:
संतृप्त नमक के विलयन में अमोनिया और कार्बन डाइऑक्साइड प्रवाहित की जाती है, जिससे सोडियम बाइकार्बोनेट का अवक्षेप बनता है:
NaCl + NH₃ + CO₂ + H₂O → NaHCO₃ + NH₄Cl
2. सोडियम बाइकार्बोनेट का तापीय अपघटन:
प्राप्त NaHCO₃ को गर्म करने पर यह विघटित होकर सोडियम कार्बोनेट बनाता है:
2NaHCO₃ → Na₂CO₃ + CO₂ + H₂O
3. वाशिंग सोडा का निर्माण:
सोडियम कार्बोनेट को जल के साथ क्रिस्टलीकृत करने पर वाशिंग सोडा प्राप्त होता है:
Na₂CO₃ + 10H₂O → Na₂CO₃·10H₂O
वाशिंग सोडा के उपयोग:
- • कठोर जल को नरम करने में — यह Mg²⁺ तथा Ca²⁺ आयनों को अवक्षेपित कर देता है
- • काँच, साबुन तथा कागज उद्योग में — वाशिंग सोडा एक महत्वपूर्ण कच्चा माल है
- • सफाई कार्यों में — कपड़े धोने, तैलीय दाग हटाने में प्रभावी
- • रासायनिक उद्योग में — बोरैक्स, कास्टिक सोडा और अन्य सोडियम यौगिकों के निर्माण में
प्रश्न 47: प्लास्टर ऑफ पेरिस के निर्माण की विधि एवं उपयोग लिखें।
उत्तर:
प्लास्टर ऑफ पेरिस (POP) के निर्माण की विधि:
प्लास्टर ऑफ पेरिस का निर्माण जिप्सम (Gypsum), CaSO₄·2H₂O को सीमित ताप पर गर्म करके किया जाता है। जिप्सम को लगभग 373 K (लगभग 100–120°C) पर गर्म करने से इसका कुछ जल अणु निकल जाता है और यह अर्ध-जलयोजित कैल्शियम सल्फेट में परिवर्तित हो जाता है, जिसे प्लास्टर ऑफ पेरिस कहते हैं।
प्लास्टर ऑफ पेरिस के उपयोग:
प्लास्टर ऑफ पेरिस (POP) के निर्माण की विधि:
प्लास्टर ऑफ पेरिस का निर्माण जिप्सम (Gypsum), CaSO₄·2H₂O को सीमित ताप पर गर्म करके किया जाता है। जिप्सम को लगभग 373 K (लगभग 100–120°C) पर गर्म करने से इसका कुछ जल अणु निकल जाता है और यह अर्ध-जलयोजित कैल्शियम सल्फेट में परिवर्तित हो जाता है, जिसे प्लास्टर ऑफ पेरिस कहते हैं।
CaSO₄·2H₂O → CaSO₄·½H₂O + 1½H₂O
प्लास्टर ऑफ पेरिस के उपयोग:
- • चिकित्सा में — टूटी हुई हड्डियों को स्थिर रखने के लिए POP पट्टी (Plaster cast) बनाई जाती है
- • निर्माण एवं सजावट में — दीवारों, छतों, झूमरों, मूर्तियों और सजावटी संरचनाओं को बनाने में
- • ढलाई कार्य में — खिलौने, मॉडल, मूर्तियाँ और साँचे (moulds) तैयार करने में
- • दरार भरने में — दीवारों की दरारें भरने और सतह को चिकना बनाने में
- • कला एवं शिल्प में — विभिन्न कलात्मक मॉडल और डिज़ाइन तैयार करने में