तत्त्वों का आवर्ती वर्गीकरण (लघु उतरिय व दीर्घ उत्तरीय प्रश्न )
Tatvon ka avarti vargikaran class 10th science subjective question answer for BSEB Matric exam 2025
तत्वों का आवर्ती वर्गीकरण लघु-उतरीय प्रश्न उत्तर Tatvon ka avarti vargikaran class 10th science subjective question answer very very important for BSEB Matric exam 2025. Read to Success
Read to Success
Q 1.
तत्वों के वर्गी करण क्या है? या तत्वों के वर्गी करण से क्या समझते हैं?
उत्तर - तत्वों को उनके समान रासायनिक और भौतिक गुणों के आधार पर समूहों और आवर्तों में व्यवस्थित करने की प्रक्रिया को तत्वों का वर्गीकरण कहते हैं, जो कि विज्ञान के क्षेत्र में एक महत्वपूर्ण कार्य है। यह प्रक्रिया केवल तत्वों को पहचानने में मदद नहीं करती, बल्कि उनके आपसी संबंधों और व्यवहारों का भी अध्ययन करने का अवसर प्रदान करती है।
Q 2. तत्वों के वर्गीकरण कि आवश्यकता क्यों हुई ? अथवा तत्वों के वर्गी करण का क्या उद्देश था ?
उत्तर – तत्वों के वर्गीकरण के कारण या उद्देश्य निम्न है - (i) तत्वों की बहुत बड़ी संख्या को समझने योग्य व्यवस्था करना (ii) समान गुणधर्म वाले तत्वों को पहचान करने के लिए (iii) तत्वों के रासायनिक गुणों की भविष्यवाणी के लिए (iv) नए तत्वों के गुणों का अनुमान लगाने के लिए
(ii) समान गुणधर्म वाले तत्वों को पहचान करने के लिए
(iii) तत्वों के रासायनिक गुणों की भविष्यवाणी के लिए
(iv) नए तत्वों के गुणों का अनुमान लगाने के लिए
3. लाभ्वाजे द्वारा वर्गी करण का आधार क्या था ? इस के दोष को लिखे |
उत्तर – लभ्वाजे ने 18 वीं शताब्दी (सन् 1789) में तत्वों का वर्गीकरण उनके भौतिक गुणों (धातु और अधातु) के आधार पर किया।
इस वर्गीकरण का दोष यह था कि इसमें रासायनिक गुणों को ध्यान में नहीं रखा गया और कुछ यौगिकों को तत्व मान लिया गया।
Q 4. डोबरेनर का त्रियक सिद्धांत क्या है ? एक उदाहरण दें |
उत्तर - डोबरेनर (19 वीं शताब्दी) में के अनुसार:- त्रियक के तत्वों को यदि तीन-तीन के समूह (त्रियक) में रखा जाए, तो मध्य तत्व का परमाणु द्रव्यमान पहले और तीसरे तत्व के परमाणु द्रव्यमान के औसत (Average) के लगभग बराबर होता है तथा तीनों तत्वों के गुणधर्म समान होते हैं।
उदाहरण: लिथियम (Li), सोडियम (Na), पोटैशियम (K) Li = 7, K = 39, औसत = (7 + 39) / 2 = 23 ≈ Na
Q5. डोबरेनर के नियम कि विशेषता तथा दोष लिखें ?
उत्तर –
विशेषता :- त्रियक के तत्वों के क्रियाशीलता का क्रम दर्शाते हैं, तत्वों के परमाणु द्रव्यमान और उनके गुणों में एक प्रकार का सम्बन्ध पाया जाता है |
दोष :- डोबरेनर का नियम सीमित तत्वों पर ही लागू था, इसलिए इसे पूर्ण वर्गीकरण नहीं माना गया।
दोष :- डोबरेनर का नियम सीमित तत्वों पर ही लागू था, इसलिए इसे पूर्ण वर्गीकरण नहीं माना गया।
तत्वों का आवर्ती वर्गीकरण लघु-उतरीय प्रश्न उत्तर
Tatvon ka avarti vargikaran class 10th science subjective short and long type question answer very very important for BSEB Matric exam 2025 – 2026
Q6. न्यूलैंडस का अष्टक नियम क्या है ?
उत्तर – न्यूलैंड्स के अनुसार, जब तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित किया जाता है, तो हर आठवाँ तत्व पहले तत्व के समान गुणधर्म प्रदर्शित करता है, ठीक वैसे ही जैसे संगीत के आठवां स्वर पहले स्वर के सामान होता है।
अथवा – परमाणु द्रव्यमान के बढ़ते क्रम में रखने पर प्रत्येक आठवाँ तत्व पहले तत्व के समान गुण दिखाता है—इसे ही न्यूलैंड्स का अष्टक नियम कहते हैं।
Q7. अष्टक के नियम का दोष क्या – क्या है लिखें ?
उत्तर – अष्टक के नयम के दोष :- (i) यह नियम केवल हल्के तत्वों (कैल्शियम तक) पर ही लागू होता है। भारी तत्वों पर नहीं (ii) कई असमान गुणों वाले तत्वों को एक ही समूह में रखा गया है | (ii) नए तत्वों के लिए कोई स्थान नहीं छोड़ा गया।
(ii) कई असमान गुणों वाले तत्वों को एक ही समूह में रखा गया है |
(ii) नए तत्वों के लिए कोई स्थान नहीं छोड़ा गया।
Q 8. मेनडलीव का आवर्त नियम लिखें |यह नियम किस नियम से प्रेरित माना जाता है ?
ऊतर - तत्वों के भौतिक और रासायनिक गुण उनके परमाणु द्रव्यमान के आवर्त फलन होते है ? अथवा – अगर तत्वों को उनके परमाणु द्रव्यमान के बढ़ते हुए सजाया जाए तो एक खाश संख्या के बाद सामान गुणवाले तत्व पाए जाते है | यह नियम अष्टक (डोबरेनर) से प्रेरित है |
Q 9. मेंडलीव के आवर्त नियम कि विशेषता को लिखें ?
उत्तर – आवर्त सारणी की विशेषता:
(i) तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित किया गया।
(ii) समान गुणधर्म वाले तत्व एक ही समूह में रखे गए।
(iii) नए तत्वों के लिए स्थान छोड़ा गया और उनके गुणों की भविष्यवाणी की गई।
(iv) गैस (हीलियम, नीयॉन) शामिल किए गए।
(v) यह आवर्त वर्गीकरण व्यवस्थित और वैज्ञानिक था।
(vi) यह तत्वों और उनके गुणों के अध्ययन में सहायक है।
(vii) इस नियम से तत्व के परमाणु द्रव्यमान में सुधार हुआ। इत्यादि।
Q 10. मेंडलीव के आवर्तसारणी कि सीमा या दोषों कोलिखें ?
उत्तर – मेंडलीव के आवर्त नियम की सीमाएँ / दोष:
(i) हाइड्रोजन का स्थान निश्चित नहीं किया जा सका।
(ii) कुछ तत्वों में परमाणु द्रव्यमान का क्रम सही नहीं था (जैसे – Co और Ni)।
(iii) समस्थानिकों (Isotopes) के लिए कोई स्थान नहीं था।
(iv) यह नियम परमाणु क्रमांक पर आधारित नहीं था।
(v) आठवें वर्ग में तीन–तीन तत्व एक साथ रखे गए थे।
Q 11. किसी आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या (Atomic Size) में क्यों परिवर्तन होता है? कारण दें।
तत्वों का आवर्ती वर्गीकरण लघु-उतरीय प्रश्न उत्तर
Tatvon ka avarti vargikaran class 10th science subjective type question answer important for BSEB Matric exam 2025 – 2026
उत्तर:- किसी आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या घटती जाती है।
कारण: - आवर्त में आगे बढ़ने पर नाभिकीय आवेश (Nuclear Charge) बढ़ता है, इससे नाभिक का आकर्षण इलेक्ट्रॉनों पर अधिक हो जाता है और इलेक्ट्रॉन नाभिक के और पास खिंच जाते हैं, परिणामस्वरूप परमाणु का आकार घट जाता है।
Q 12. समूह /वर्ग (Group) में ऊपर से नीचे जाने पर धात्विक गुण (Metallic Character) कैसे बदलता है?
उत्तर - समूह में ऊपर से नीचे जाने पर धात्विक गुण बढ़ता जाता है।
कारण: - नीचे जाने पर परमाणु में आवरणों (shells) की संख्या बढ़ती है, जिससे परमाणु त्रिज्या बढ़ती है और नाभिक का बाहरी इलेक्ट्रॉनों पर आकर्षण कम हो जाता है। परिणामस्वरूप इलेक्ट्रॉन छोड़ने की प्रवृत्ति बढ़ती है, इसलिए धात्विक गुण बढ़ता है।
13. मोसले के आधुनिक आवर्त नियम को लिखें ?
उत्तर - मोसले का आवर्त नियम (Moseley’s Periodic Law):-
मोसले के अनुसार, तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु क्रमांक (Atomic Number) के आवर्त फलन होते हैं।
Q 14. आवर्त नियम कि सीमा को सक्षिप्त लिखें |
उत्तर –
(i) हाइड्रोजन (H) की अनिश्चित स्थिति : हाइड्रोजन, क्षारीय धातुओं (वर्ग 1) और हैलोजन (वर्ग 17) दोनों के साथ समानता दर्शाता है। फिर भी, इसे केवल परमाणु संख्या 1 होने के कारण सबसे ऊपर रखा गया है, जो पूरी तरह संतोषजनक नहीं माना जाता। (ii) लैन्थेनाइड्स और एक्टिनाइड्स का स्थान : f-ब्लॉक के तत्वों (लैन्थेनाइड्स और एक्टिनाइड्स) को मुख्य आवर्त सारणी के अंदर न रखकर नीचे अलग पट्टियों में रखा गया है। यह आवर्त सारणी की मुख्य संरचना से बाहर प्रतीत होते हैं। (iii) हीलियम (He) का स्थान : इलेक्ट्रॉनिक विन्यास के अनुसार हीलियम (1s²) को s-ब्लॉक (वर्ग 2) में होना चाहिए था, लेकिन अक्रिय गैस होने के कारण इसे p-ब्लॉक (वर्ग 18) में रखा गया है।
संक्षिप्त रूप - हाइड्रोजन की स्थिति अनिश्चित है लैन्थेनाइड्स और एक्टिनाइड्स को मुख्य आवर्त सारणी से अलग नीचे रखा गया है। हीलियम का स्थान s-ब्लॉक में होना चाहिए, पर इसे वर्ग 18 में रखा गया है।
Q 15.आवर्त सारणी के लघु आवर्त और दीर्घ आवर्त क्या है इन कि संख्या लिखें ?
उत्तर – लघु आवर्त (Short Periods)
जिन आवर्तों में तत्वों की संख्या कम होती है, उन्हें लघु आवर्त कहते हैं।
अथवा – प्रथम आवर्त – 2 तत्व, द्वितीय आवर्त – 8 तत्व, तृतीय आवर्त – 8 तत्व
👉 कुल 3 लघु आवर्त होते हैं।
दीर्घ आवर्त (Long Periods)
जिन आवर्तों में तत्वों की संख्या अधिक होती है, उन्हें दीर्घ आवर्त कहते हैं।
अथवा – चतुर्थ आवर्त – 18 तत्व, पंचम आवर्त – 18 तत्व, षष्ठ आवर्त – 32 तत्व
👉 कुल 3 दीर्घ आवर्त होते हैं।
नोट:- सप्तम आवर्त अपूर्ण (अपूर्ण दीर्घ) आवर्त माना जाता है।
Q 16. दुष्यप्राय मृदा क्या है ? उदहारण दें |
परिभाषा :-
आवर्त सारणी के वे तत्व जिनके ऑक्साइड्स
पुराने समय में "मृदा" (Earth) कहे जाते थे और
जिन्हें उनके अयस्कों से शुद्ध रूप में अलग करना (निष्कर्षण)
बहुत कठिन था, उन्हें दुर्लभ मृदा तत्व कहा जाता है।उदाहरण :-
सीरियम,
लैन्थेनम,
नियोडिमियम,
प्रासियोडिमियमनोट :-
ये तत्व आधुनिक आवर्त सारणी के
समूह 3 में पाए जाते हैं।
इनमें मुख्य रूप से लैन्थेनाइड्स (Lanthanides)
श्रेणी के तत्व शामिल होते हैं। कुल संख्या :-
इनकी कुल संख्या 17 है
(जिसमें 15 लैन्थेनाइड्स +
स्कैन्डियम +
इट्रियम शामिल हैं)।
यह नियम अष्टक (डोबरेनर) से प्रेरित है |
Q 9. मेंडलीव के आवर्त नियम कि विशेषता को लिखें ?
उत्तर – आवर्त सारणी की विशेषता:
(i) तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित किया गया।
(ii) समान गुणधर्म वाले तत्व एक ही समूह में रखे गए।
(iii) नए तत्वों के लिए स्थान छोड़ा गया और उनके गुणों की भविष्यवाणी की गई।
(iv) गैस (हीलियम, नीयॉन) शामिल किए गए।
(v) यह आवर्त वर्गीकरण व्यवस्थित और वैज्ञानिक था।
(vi) यह तत्वों और उनके गुणों के अध्ययन में सहायक है।
(vii) इस नियम से तत्व के परमाणु द्रव्यमान में सुधार हुआ। इत्यादि।
Q 10. मेंडलीव के आवर्तसारणी कि सीमा या दोषों कोलिखें ?
उत्तर – मेंडलीव के आवर्त नियम की सीमाएँ / दोष:
(i) हाइड्रोजन का स्थान निश्चित नहीं किया जा सका।
(ii) कुछ तत्वों में परमाणु द्रव्यमान का क्रम सही नहीं था (जैसे – Co और Ni)।
(iii) समस्थानिकों (Isotopes) के लिए कोई स्थान नहीं था।
(iv) यह नियम परमाणु क्रमांक पर आधारित नहीं था।
(v) आठवें वर्ग में तीन–तीन तत्व एक साथ रखे गए थे।
Q 11. किसी आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या (Atomic Size) में क्यों परिवर्तन होता है? कारण दें।
तत्वों का आवर्ती वर्गीकरण लघु-उतरीय प्रश्न उत्तर
Tatvon ka avarti vargikaran class 10th science subjective type question answer important for BSEB Matric exam 2025 – 2026
उत्तर:- किसी आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या घटती जाती है।
कारण: - आवर्त में आगे बढ़ने पर नाभिकीय आवेश (Nuclear Charge) बढ़ता है, इससे नाभिक का आकर्षण इलेक्ट्रॉनों पर अधिक हो जाता है और इलेक्ट्रॉन नाभिक के और पास खिंच जाते हैं, परिणामस्वरूप परमाणु का आकार घट जाता है।
Q 12. समूह /वर्ग (Group) में ऊपर से नीचे जाने पर धात्विक गुण (Metallic Character) कैसे बदलता है?
उत्तर - समूह में ऊपर से नीचे जाने पर धात्विक गुण बढ़ता जाता है।
कारण: - नीचे जाने पर परमाणु में आवरणों (shells) की संख्या बढ़ती है, जिससे परमाणु त्रिज्या बढ़ती है और नाभिक का बाहरी इलेक्ट्रॉनों पर आकर्षण कम हो जाता है। परिणामस्वरूप इलेक्ट्रॉन छोड़ने की प्रवृत्ति बढ़ती है, इसलिए धात्विक गुण बढ़ता है।
13. मोसले के आधुनिक आवर्त नियम को लिखें ?
उत्तर - मोसले का आवर्त नियम (Moseley’s Periodic Law):- मोसले के अनुसार, तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु क्रमांक (Atomic Number) के आवर्त फलन होते हैं।
Q 14. आवर्त नियम कि सीमा को सक्षिप्त लिखें |
उत्तर –
(i) हाइड्रोजन (H) की अनिश्चित स्थिति : हाइड्रोजन, क्षारीय धातुओं (वर्ग 1) और हैलोजन (वर्ग 17) दोनों के साथ समानता दर्शाता है। फिर भी, इसे केवल परमाणु संख्या 1 होने के कारण सबसे ऊपर रखा गया है, जो पूरी तरह संतोषजनक नहीं माना जाता। (ii) लैन्थेनाइड्स और एक्टिनाइड्स का स्थान : f-ब्लॉक के तत्वों (लैन्थेनाइड्स और एक्टिनाइड्स) को मुख्य आवर्त सारणी के अंदर न रखकर नीचे अलग पट्टियों में रखा गया है। यह आवर्त सारणी की मुख्य संरचना से बाहर प्रतीत होते हैं। (iii) हीलियम (He) का स्थान : इलेक्ट्रॉनिक विन्यास के अनुसार हीलियम (1s²) को s-ब्लॉक (वर्ग 2) में होना चाहिए था, लेकिन अक्रिय गैस होने के कारण इसे p-ब्लॉक (वर्ग 18) में रखा गया है।
संक्षिप्त रूप - हाइड्रोजन की स्थिति अनिश्चित है लैन्थेनाइड्स और एक्टिनाइड्स को मुख्य आवर्त सारणी से अलग नीचे रखा गया है। हीलियम का स्थान s-ब्लॉक में होना चाहिए, पर इसे वर्ग 18 में रखा गया है।
Q 15.आवर्त सारणी के लघु आवर्त और दीर्घ आवर्त क्या है इन कि संख्या लिखें ?
उत्तर – लघु आवर्त (Short Periods)
जिन आवर्तों में तत्वों की संख्या कम होती है, उन्हें लघु आवर्त कहते हैं।
अथवा – प्रथम आवर्त – 2 तत्व, द्वितीय आवर्त – 8 तत्व, तृतीय आवर्त – 8 तत्व
👉 कुल 3 लघु आवर्त होते हैं।
दीर्घ आवर्त (Long Periods)
जिन आवर्तों में तत्वों की संख्या अधिक होती है, उन्हें दीर्घ आवर्त कहते हैं।
अथवा – चतुर्थ आवर्त – 18 तत्व, पंचम आवर्त – 18 तत्व, षष्ठ आवर्त – 32 तत्व
👉 कुल 3 दीर्घ आवर्त होते हैं।
नोट:- सप्तम आवर्त अपूर्ण (अपूर्ण दीर्घ) आवर्त माना जाता है।
उत्तर – लघु आवर्त (Short Periods)
जिन आवर्तों में तत्वों की संख्या कम होती है, उन्हें लघु आवर्त कहते हैं।
अथवा – प्रथम आवर्त – 2 तत्व, द्वितीय आवर्त – 8 तत्व, तृतीय आवर्त – 8 तत्व
👉 कुल 3 लघु आवर्त होते हैं।
दीर्घ आवर्त (Long Periods)
जिन आवर्तों में तत्वों की संख्या अधिक होती है, उन्हें दीर्घ आवर्त कहते हैं।
अथवा – चतुर्थ आवर्त – 18 तत्व, पंचम आवर्त – 18 तत्व, षष्ठ आवर्त – 32 तत्व
👉 कुल 3 दीर्घ आवर्त होते हैं।
नोट:- सप्तम आवर्त अपूर्ण (अपूर्ण दीर्घ) आवर्त माना जाता है।
Q 16. दुष्यप्राय मृदा क्या है ? उदहारण दें |
परिभाषा :-
आवर्त सारणी के वे तत्व जिनके ऑक्साइड्स
पुराने समय में "मृदा" (Earth) कहे जाते थे और
जिन्हें उनके अयस्कों से शुद्ध रूप में अलग करना (निष्कर्षण)
बहुत कठिन था, उन्हें दुर्लभ मृदा तत्व कहा जाता है।उदाहरण :-
सीरियम,
लैन्थेनम,
नियोडिमियम,
प्रासियोडिमियमनोट :-
ये तत्व आधुनिक आवर्त सारणी के
समूह 3 में पाए जाते हैं।
इनमें मुख्य रूप से लैन्थेनाइड्स (Lanthanides)
श्रेणी के तत्व शामिल होते हैं। कुल संख्या :-
इनकी कुल संख्या 17 है
(जिसमें 15 लैन्थेनाइड्स +
स्कैन्डियम +
इट्रियम शामिल हैं)।
दीर्घ उतरिये प्रश्न ( 5 – अंक वाले प्रश्न उत्तर )Tatvon ka avarti vargikaran class 10th science subjective question answer very very important for BSEB Matric exam 2025.
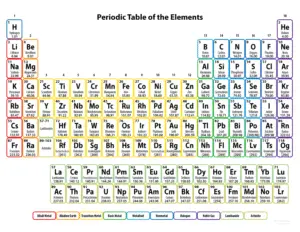
Q 17. आधुनिक आवर्त सारणी की विशेषताओं का वर्णन करें। (2019, 2022)
उत्तर – आधुनिक आवर्त सारणी का निर्माण
हेनरी मोसले द्वारा प्रतिपादित
आधुनिक आवर्त नियम पर आधारित है।
इस नियम के अनुसार – तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु क्रमांक के आवर्ती फलन होते हैं।आधुनिक आवर्त सारणी की प्रमुख विशेषताएँ निम्नलिखित हैं –
1. परमाणु क्रमांक के आधार पर व्यवस्था :-
आधुनिक आवर्त सारणी में तत्वों को उनके
बढ़ते हुए परमाणु क्रमांक
के अनुसार व्यवस्थित किया गया है। इससे मैण्डलीव सारणी की कई
त्रुटियाँ दूर
हो गईं, जैसे – आर्गन-पोटैशियम तथा
कोबाल्ट-निकेल की समस्या। 2. आवर्तों और समूहों की निश्चित संख्या :-
इस सारणी में 7 आवर्त (Periods)
और 18 समूह (Groups) हैं।
एक ही समूह के तत्वों के रासायनिक गुण समान होते हैं,
जबकि एक ही आवर्त में बाएँ से दाएँ जाने पर
गुणों में क्रमिक परिवर्तन होता है। 3. इलेक्ट्रॉनिक विन्यास पर आधारित वर्गीकरण :- तत्वों के स्थान उनके
इलेक्ट्रॉनिक विन्यास
के आधार पर निश्चित किए गए हैं।
एक ही समूह के तत्वों में
संयोजक इलेक्ट्रॉनों की संख्या समान
होती है, जिससे उनके गुणों को समझना आसान हो जाता है। 4. s, p, d एवं f ब्लॉकों में विभाजन :- आधुनिक आवर्त सारणी को चार ब्लॉकों –
s, p, d और f में बाँटा गया है। इससे क्षारीय धातु,
संक्रमण तत्व तथा
आंतरिक संक्रमण तत्वों
का अध्ययन सरल हो गया है। 5. समस्थानिकों को उचित स्थान :- समस्थानिकों
का परमाणु क्रमांक समान होने के कारण उन्हें
एक ही स्थान दिया गया है,
जो मैण्डलीव आवर्त सारणी की एक बड़ी कमी थी।निष्कर्ष (एक पंक्ति में) :-आधुनिक आवर्त सारणी एक वैज्ञानिक, तर्कसंगत और सुव्यवस्थित व्यवस्था है,
जो तत्वों के गुणों को समझने में अत्यंत सहायक है।
Q 18. तत्वों के गुणधर्मों में आवर्तिता (Periodicity) से आप क्या समझते हैं? किसी समूह और आवर्त में निम्नलिखित गुणों में क्या परिवर्तन होता है? (2020, 2023)
उत्तर – तत्वों के गुणधर्मों में आवर्तिता (Periodicity)
परिभाषा :-
जब तत्वों को उनके
परमाणु क्रमांक
के बढ़ते क्रम में
आधुनिक आवर्त सारणी
में रखा जाता है, तो उनके
भौतिक एवं रासायनिक गुण
एक निश्चित क्रम के बाद पुनः दोहराए जाते हैं।
तत्वों के गुणों के इस
नियमित दोहराव
को ही
आवर्तिता (Periodicity)
कहते हैं।
आवर्तिता का कारण :-
आवर्तिता का मुख्य कारण तत्वों का
इलेक्ट्रॉनिक विन्यास
है। जब
संयोजक (Valence) इलेक्ट्रॉनों
की व्यवस्था दोबारा समान हो जाती है, तब तत्वों के गुण भी समान हो जाते हैं।
समूह (Group) और आवर्त (Period) में गुणों में परिवर्तन
(A) समूह में ऊपर से नीचे जाने पर गुणों में परिवर्तन
परमाणु त्रिज्या (Atomic Radius) –
परमाणु त्रिज्या बढ़ती है, क्योंकि
ऊर्जा स्तरों
की संख्या बढ़ जाती है।
धात्विक गुण (Metallic Character) –
धात्विक गुण बढ़ता है, क्योंकि बाहरी इलेक्ट्रॉनों को छोड़ना आसान हो जाता है।
अधात्विक गुण (Non-metallic Character) –
अधात्विक गुण घटता है, क्योंकि इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कम हो जाती है।
आयनन ऊर्जा (Ionisation Energy) –
आयनन ऊर्जा घटती है, क्योंकि नाभिक का प्रभाव बाहरी इलेक्ट्रॉनों पर कम हो जाता है।
(B) आवर्त में बाएँ से दाएँ जाने पर गुणों में परिवर्तन
परमाणु त्रिज्या –
बाएँ से दाएँ जाने पर परमाणु त्रिज्या घटती जाती है,
क्योंकि नाभिकीय आवेश बढ़ता है।
धात्विक गुण –
धात्विक गुण घटता है, क्योंकि इलेक्ट्रॉन छोड़ना कठिन हो जाता है।
अधात्विक गुण –
अधात्विक गुण बढ़ता है, क्योंकि इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति बढ़ती है।
आयनन ऊर्जा –
आयनन ऊर्जा बढ़ती है, क्योंकि बाहरी इलेक्ट्रॉन नाभिक से अधिक मजबूती से जुड़े होते हैं।
निष्कर्ष :-
तत्वों के गुणों में नियमित रूप से होने वाला यह परिवर्तन
आवर्तिता कहलाता है तथा आधुनिक आवर्त सारणी की
सबसे महत्वपूर्ण विशेषता है, जो तत्वों के व्यवहार को
समझने में अत्यंत सहायक है।
Q 19.आधुनिक आवर्त सारणी और मेंद्लीव कि आवर्त सरणी में अंतर स्पष्ट करें?
उत्तर – आधुनिक आवर्त सारणी एवं मेंडलीव की आवर्त सारणी में अंतर
| क्रम | मेंडलीव की आवर्त सारणी | आधुनिक आवर्त सारणी |
|---|---|---|
| 1. | तत्वों को परमाणु द्रव्यमान के आधार पर रखा गया है | तत्वों को परमाणु क्रमांक के आधार पर रखा गया है |
| 2. | आवर्त नियम : गुण परमाणु द्रव्यमान के आवर्ती फलन | आवर्त नियम : गुण परमाणु क्रमांक के आवर्ती फलन |
| 3. | समस्थानिकों के लिए स्थान स्पष्ट नहीं | समस्थानिकों को एक ही स्थान दिया गया |
| 4. | आर्गन–पोटैशियम, कोबाल्ट–निकेल जैसी विसंगतियाँ | ऐसी सभी विसंगतियाँ दूर हो गई |
| 5. | कुल 8 समूह (A और B उपसमूह) | कुल 18 समूह |
| 6. | इलेक्ट्रॉनिक विन्यास का आधार नहीं | वर्गीकरण इलेक्ट्रॉनिक विन्यास पर आधारित |
| 7. | d और f ब्लॉक का स्पष्ट विभाजन नहीं | s, p, d, f ब्लॉक का स्पष्ट विभाजन |
| 8. | हाइड्रोजन का स्थान अस्पष्ट | हाइड्रोजन को परमाणु क्रमांक 1 के आधार पर रखा गया |
Scroll to Top